Exercici 8 novembre 2007
La tendència a l'estabilitat dels elements i compostos, permetrà actuar a les forces atractives entre els fragments atòmics i moleculars. Aquestes forces atractives donaran lloc a estructures moleculars tridimensionals amb unes propietats característiques pròpies.
Actualment es conèixen uns 20 mil·lions de molècules diferents. L'existència d'espècies poliatòmiques estables indica que els àtoms poden interactuar entre ells per formar molècules o altres tipus d'agregats . Aquesta formació és exotèrmica: el sistema que s'obté finalment té una energia inferior a la suma d'energies dels seus composants, els fragments atòmics inicials. Quan aquesta disminució d'energia és superior a unes 10 kcal per mol d'àtoms parlem de la formació d'enllaços químics. En aquest cas es formen espècies que tenen propietats químiques ben definides i característiques. Una reacció química es pot entendre com una reordenació o reorganització dels enllaços inicials. Se'n trenquen de vells i se'n formen de nous. Fragment extret d'aquí.
A partir d'aquesta breu introducció i utilitzant el llibre i els enllaços proposats, respon les següents preguntes al teu dossier:
enllaços proposats
http://stark.udg.es/%7Eemili/docent/eqem/pdf_master/eqem_05master.pdfhttp://wapedia.mobi/ca/Enlla
http://usuaris.tinet.org/acas
http://www.educaplus.org
http://www.xtec.cat/formaciotic
1.- Perquè es produeixen els enllaços químics?
2.- Quina és la diferència entre l'enllaç covalent i l'enllaç iònic?
3.- Posa'n un exemple.
4.-de què estan formats els enllaços químics?
5.- en què consisteix l'enllaç metàl·lic?
6.- de què estan fets els enllaços covalents?
7.- descriu l'enllaç iònic.
8.- diferències entre enllaç metàl·lic i enllaç ionic.
9.- Cita quatre tipus d'enllaços químics.
10.- què diu la regla de l'octet?
11.- què són els electrons de valència?
Chemical Bonding
Chemical compounds are formed by the joining of two or more atoms. A stable compound occurs when the total energy of the combination has lower energy than the separated atoms. The bound state implies a net attractive force between the atoms ... a chemical bond. The two extreme cases of chemical bonds are:
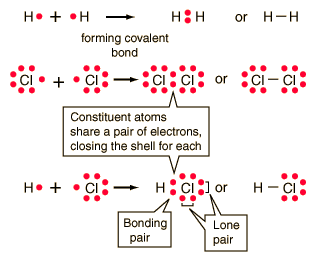
Covalent bond: bond in which one or more pairs of electrons are shared by two atoms.
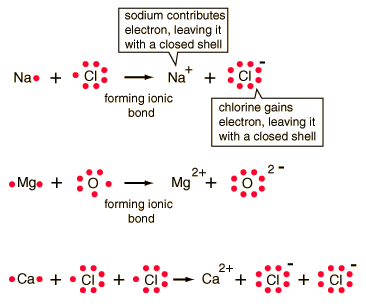
Ionic bond: bond in which one or more electrons from one atom are removed and attached to another atom, resulting in positive and negative ions which attract each other.
Other types of bonds include metallic bonds and hydrogen bonding. The attractive forces between molecules in a liquid can be characterized as van der Waals bonds
Covalent Bonds
Covalent chemical bonds involve the sharing of a pair of valence electrons by two atoms, in contrast to the transfer of electrons in ionic bonds. Such bonds lead to stable molecules if they share electrons in such a way as to create a noble gas configuration for each atom.
Hydrogen gas forms the simplest covalent bond in the diatomic hydrogen molecule. The halogens such as chlorine also exist as diatomic gases by forming covalent bonds. The nitrogen and oxygen which makes up the bulk of the atmosphere also exhibits covalent bonding in forming diatomic molecules.
|
| Covalent bonding can be visualized with the aid of Lewis diagrams. |
Ionic Bonds
In chemical bonds, atoms can either transfer or share their valence electrons. In the extreme case where one or more atoms lose electrons and other atoms gain them in order to produce a noble gas electron configuration, the bond is called an ionic bond.
Typical of ionic bonds are those in the alkali halides such as sodium chloride, NaCl.
|
| Ionic bonding can be visualized with the aid of Lewis diagrams. |
Metallic Bonds
The properties of metals suggest that their atoms possess strong bonds, yet the ease of conduction of heat and electricity suggest that electrons can move freely in all directions in a metal. The general observations give rise to a picture of "positive ions in a sea of electrons" to describe metallic bonding.
Bond: enllaç
1 comentari:
hola albert mira que te enviado el trabajo para k me dijas si esta bien
no se si el correo esta bien
es este? fqac4a@gmail.com
ueno si esta mal
por favor enviame un mensaje al:
javi_mkm@hotmail.com
Con tu correo okis¿?
venga merci albert
Javier Moreno
Publica un comentari a l'entrada